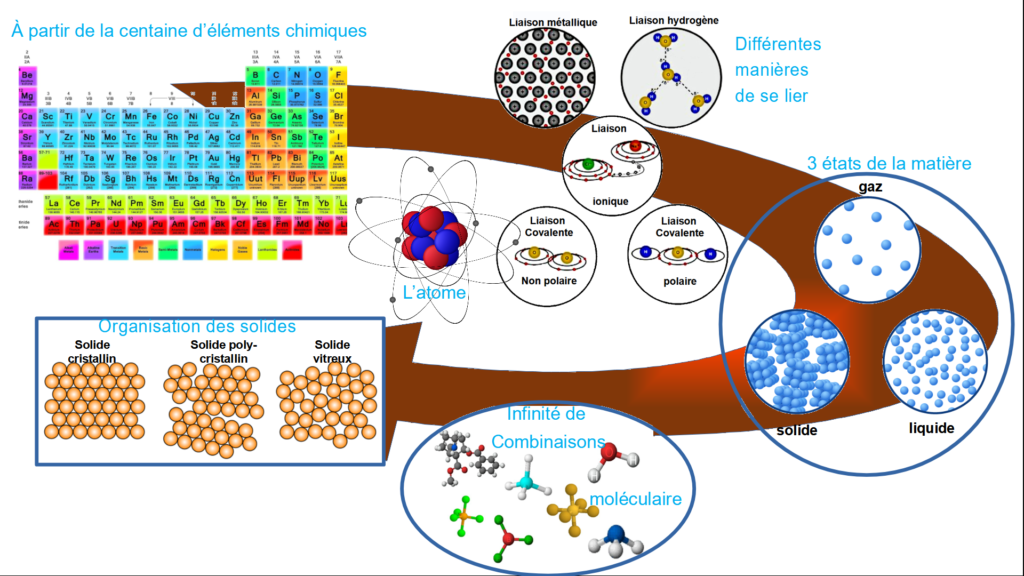
Chaque atome comporte autant d’électrons que de protons, afin d’être électriquement neutre. Les électrons sont très mobiles autour du noyau. Ils n’ont pas tous la même énergie et sont répartis à des niveaux différents depuis le noyau. Plus l’électron est proche du noyau, plus il faudra fournir de l’énergie pour l’extraire de son orbite.
Plus il est éloigné, et plus l’électron sera facilement enlevé. Concernant l’orbitale externe, elle peut être incomplètement remplie.L’atome pourra être stabilisé en partageant ses électrons avec un autre atome dont son orbitale externe est presque remplie.
En s’associant, les atomes vont créer des assemblages complexes appelés molécules. Le moteur de ces assemblages est la liaison atomique. Il existe 4 types de liaisons :
-La liaison ionique implique un transfert d’électron d’un atome à un autre. Elle lie des métaux et des non-métaux.
- La liaison covalente est une liaison chimique dans laquelle deux atomes partagent 2 électrons
- Dans les métaux, les électrons se déplacent facilement
- La liaison hydrogène consiste essentiellement dans l’interaction entre deux molécules
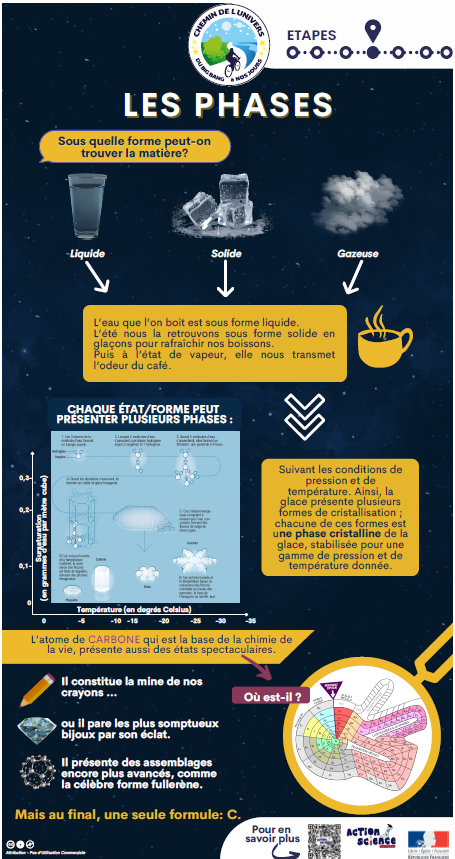
L’existence d’une molécule ne sera alors possible que si les conditions physico-chimiques le permettent. Son état, solide, liquide ou gaz, sera conditionné à la pression et la température de son environnement ; on définit ainsi les phases de la matière.
A chaque passage d’un état à un autre, une quantité d’énergie sera dépensée ou récupérée. La science qui permet de comprendre les échanges des énergies lors des changements de phase, s’appelle la thermodynamique.
Chaque état peut présenter plusieurs phases suivant les conditions de pression et de température. Ainsi, la glace présente plusieurs formes de cristallisation ; chacune de ces formes est une phase cristalline de la glace, stabilisée pour une gamme de pression et de température donnée.
Dans la phase solide, la matière pourra être peu organisée ; ce sera un verre, ou très organisée et ce sera un cristal.
Ainsi, on peut voir que depuis le Big Bang, la matière s’est considérablement complexifiée. Des 4 atomes créés après le Big Bang, il était difficile de construire des assemblages complexes. C’est grâce à la création de la grande diversité des atomes, leur agglomération et leur équilibre avec les conditions extérieures, que la matière va présenter de grandes variétés de forme et d’état. C’est grâce à cette aptitudes qu’ont les atomes à se lier entre eux, que notre terre présente cette si grande variété minérale et moléculaire!
Cela répond à une loi générale, où tout tend vers le désordre! c’est ce qu’exprime le terme « entropie »; plus le désordre (ou la complexité) augmente, plus l’entropie augmente.